Regulamentação de Dispositivos Médicos na África do Sul
A regulamentação de dispositivos médicos na África do Sul é realizada pela Agência Sul-Africana de Produtos Regulamentados (South African Health Products Regulatory Authority – SAHPRA). Essa agência governamental é responsável por garantir que todos os dispositivos médicos comercializados no país sejam seguros, eficazes e de alta qualidade.
O processo de regulamentação envolve a avaliação detalhada de cada dispositivo, levando em consideração fatores como sua composição, funcionalidade, riscos associados e eficácia clínica. Os dispositivos médicos são classificados em categorias, dependendo do grau de risco que apresentam aos pacientes e usuários.
Conheça alguns dos serviços que prestamos na África do Sul:
Recomendação de Classificação
Revisão de Conformidade de Dispositivos Médicos
Alteração de Licença (hospedagem) ou Solicitação de Licença
Alteração (hospedagem) ou Envio de Inscrição
Administração de Importação
Administração da Distribuição
1. Recomendação de Classificação
O ponto de partida para todos os dispositivos médicos e IVDs destinados ao mercado sul-africano passa por uma classificação formal e revisão de conformidade de acordo com as diretrizes locais, após o recebimento da seguinte documentação técnica:
Your Content Goes Here
Your Content Goes Here
Your Content Goes Here
- MHRA Reino Unido
- Japão PMDA
- ANVISA
- Health Canada
- Australian TGA
- US FDA PMA
- WHO
Your Content Goes Here
A estrutura regulatória de dispositivos médicos possui um sistema de classificação para dispositivos médicos e IVDs, de acordo com os regulamentos de dispositivos médicos da Lei 101 de 1965, estabelecidos nas Regras de Classificação de Dispositivos Médicos. A intenção dos fabricantes do dispositivo médico é crucial ao determinar a classificação de um dispositivo médico.
Os dispositivos médicos são classificados nos seguintes níveis:
| Classificação | Nível de risco |
|---|---|
| Classe A (Classe I) | Baixo risco |
| Classe B (Classe IIa) | Risco baixo a moderado |
| Classe C (Classe IIb) | Moderado – alto risco |
| Classe D (Classe III) | Alto risco – quando o risco está relacionado ao paciente ou à saúde pública |
O resultado da revisão de classificação e conformidade será um documento de Recomendação de Classificação e um documento de Revisão de Conformidade de Dispositivos Médicos.
A Recomendação de Classificação fornece detalhes específicos para o produto e as regras de classificação mais adequadas ao produto. A Revisão de Conformidade de Dispositivos Médicos é uma análise do rótulo fornecido e da ilustração da IFU em relação à diretriz dos Princípios Essenciais, resultando em um documento indicando quaisquer alterações a serem feitas no rótulo ou na IFU, conforme necessário.
2. Revisão de Conformidade de Dispositivos Médicos
Após a conclusão do processo de classificação, os dispositivos médicos e IVDs são avaliados de acordo com os Princípios Essenciais de Segurança e Desempenho de dispositivos médicos e IVDs. Esta diretriz fornece os requisitos relativos a características de segurança e desempenho de dispositivos médicos e IVDs.
É responsabilidade do titular da licença demonstrar a conformidade de seus dispositivos médicos e IVDs na África do Sul.
Existem seis princípios gerais essenciais de segurança e desempenho que se aplicam a todos os dispositivos médicos. Há mais nove Princípios Essenciais de Segurança e Desempenho sobre projeto e construção a serem aplicados a dispositivos caso a caso.
- Uso de dispositivos médicos para não comprometer a saúde e a segurança
- Projeto e construção de dispositivos médicos em conformidade com os princípios de segurança
- Os dispositivos médicos devem ser adequados para o fim a que se destinam
- Segurança a longo prazo
- Os dispositivos médicos não devem ser afetados adversamente pelo transporte ou armazenamento
- Os benefícios dos dispositivos médicos superam quaisquer efeitos colaterais
- Propriedades químicas, físicas e biológicas
- Infecção e contaminação microbiana
- Construção e propriedades ambientais
- Dispositivos médicos com função de medição
- Proteção contra radiação
- Dispositivos médicos conectados ou equipados com uma fonte de energia
- Informações a serem fornecidas com dispositivos médicos
- Evidência clínica
- Princípios aplicáveis apenas a dispositivos médicos IVD
Os fabricantes podem demonstrar que os Princípios Essenciais de Segurança e Desempenho foram atendidos para dispositivos médicos, das seguintes maneiras:
- Uma análise de risco documentada e detalhada
- Os resultados do teste do dispositivo médico
- Pesquisas bibliográficas
- Cópias do rótulo, embalagem e instruções de uso para demonstrar que os requisitos de informação foram atendidos
- Opinião especializada
- O dossiê de projeto, se aplicável
As informações devem ser mantidas pelo titular da licença e fornecidas à Autoridade mediante solicitação.
As normativas comumente usadas pelo fabricante de dispositivos médicos são:
- ISO 14971 – Aplicação da gestão de riscos a dispositivos médicos
- ISO 13485 – Sistemas de Gestão da Qualidade: Requisitos para fins regulatórios
- ISO 10993 – Avaliação biológica de dispositivos médicos
3. Alteração de Licença (hospedagem) ou Solicitação de Licença
O passo final para entrar no mercado sul-africano é adquirir o licenciamento dos produtos. Existem duas maneiras principais de conseguir isso, por meio de serviços de hospedagem de uma consultoria, ou por meio da aplicação de uma licença de dispositivo médico.
Após a avaliação do resultado pretendido, iremos aconselhá-lo e providenciar o necessário para ela.
Uma licença de fabricante de dispositivos médicos é uma autorização regulamentar emitida pela SAHPRA que concede permissão a uma empresa ou organização para fabricar e distribuir dispositivos médicos na África do Sul.
Para obter uma licença de fabricante, a empresa deve demonstrar conformidade com os requisitos e padrões regulamentares estabelecidos pela autoridade reguladora. Isso inclui adesão aos sistemas de gestão de qualidade (ISO13485:2016), princípios de segurança e desempenho do produto e outros regulamentos aplicáveis específicos para dispositivos médicos.
A licença do fabricante inclui disposições para que o requerente inclua atividades de importação, exportação e distribuição, mas não permite a compra de produto fabricado ou distribuído localmente. Os documentos incluídos na submissão incluem o Manual da Qualidade, Índice SOP e informações técnicas da documentação do produto.
Semelhante à licença para fabricar, importar, exportar ou distribuir, a licença do atacadista é uma autorização regulatória emitida pela SAHPRA que concede permissão a uma empresa ou organização para comprar dispositivos médicos de origem local.
Para obter uma licença de atacadista, a empresa deve demonstrar conformidade com os requisitos e padrões regulamentares estabelecidos pela autoridade reguladora. Isso inclui adesão aos sistemas de gestão da qualidade (ISO13485:2016), segurança do produto e princípios de desempenho e outros regulamentos aplicáveis específicos para dispositivos médicos.
A licença do atacadista inclui disposições para que o requerente inclua atividades de atacado e distribuição, mas não permite a fabricação, importação ou exportação do produto. Os documentos incluídos na submissão incluem o Arquivo Mestre de plantas, Índice SOP e documentação técnica do produto.
4. Serviços de hospedagem
A Passarini Group detém uma licença para importar, exportar e distribuir dispositivos médicos e IVDs de todas as classes, permitindo a prestação de serviços de hospedagem para clientes que desejam entrar no mercado sul-africano com confiança.
A empresa opera em um sistema de gestão de qualidade ISO13485:2016, com procedimentos implementados para garantir o cumprimento de todos os regulamentos aplicáveis ao seu produto. Além disso, a Passarini Group fornece representação regulatória à SAHPRA, garantindo proteção contra incertezas. O processo conduzido inclui controle e responsabilidade de liberação do produto final, relatórios de reações adversas a dispositivos, recalls de produtos, administração de importação e administração de distribuição.
Por meio do serviço de hospedagem, sua empresa consegue entrar no mercado sul-africano com confiança no compliance.
5. Administração de importação
Como requisito para todos os dispositivos médicos e IVDs importados para a África do Sul, apenas uma entidade licenciada tem permissão para realizar essas atividades. Compreendendo as complexidades e incertezas do processo de importação, a Passarini Group fornece serviços para garantir que o produto entre no mercado com precisão simplificada.
Como cliente de hosting da Passarini Group este serviço está incluído e obrigatório, no entanto é um serviço adicional para todos os clientes.
6. Administração de Distribuição
Como requisito para todos os dispositivos médicos e IVDs distribuídos na África do Sul, apenas uma entidade licenciada tem permissão para realizar essas atividades.
Compreendendo as complexidades e incertezas do processo de distribuição, a Passarini Group fornece serviços para garantir que o produto seja distribuído no mercado com precisão otimizada.
Como cliente de hosting da Passarini Group, este serviço está incluído e obrigatório, no entanto é um serviço adicional para todos os clientes.
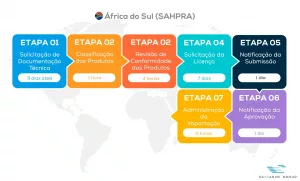
Visualize abaixo nosso fluxo completo do processo SAHPRA
Permita-nos auxiliá-lo na Conformidade Regulatória SAHPRA
A Passarini Group conta com consultores extremamente experientes, oferecendo especialização em auxiliar empresas fabricantes, fornecedores ou importadores de dispositivos médicos a alcançar a conformidade com os requisitos do SAHPRA, permitindo-lhes obter acesso ao mercado africano.
Nossos consultores experientes forneceram assistência a um grande número de empresas de dispositivos médicos, auxiliando-as no processo de licenciamento, além de aplicar diariamente o conceito One Stop Shop em sua empresa com soluções práticas.



